Elenco di elementi
»
afnio
»
americio
»
Argento
»
argo
»
arsenico
»
astato
»
attinio
»
azoto
»
bario
»
berillio
»
bismuto
»
bohrium
»
Boro
»
bromo
»
cadmio
»
calcio
»
carbonio
»
cerio
»
cesio
»
cloro
»
cobalto
»
cromo
»
curio
»
dubnio
»
elio
»
erbio
»
europio
»
fermium
»
ferro
»
flerovio
»
fluoro
»
fosforo
»
francium
»
gallio
»
germanio
»
hassium
»
idrogeno
»
indio
»
iodio
»
iridio
»
itterbio
»
ittrio
»
krypton
»
lantanio
»
latta
»
litio
»
lutezio
»
magnesio
»
mercurio
»
neodimio
»
neon
»
nettunio
»
nichel
»
Nihonium
»
niobio
»
Nobelium
»
olmio
»
oro
»
osmio
»
ossigeno
»
palladio
»
platino
»
plutonio
»
polonio
»
portare
»
potassio
»
prometeo
»
radio
»
radon
»
rame
»
renio
»
rodio
»
rubidio
»
rutenio
»
samario
»
scandio
»
selenio
»
silicio
»
sodio
»
stronzio
»
tallio
»
tantalio
»
tecnezio
»
tellurio
»
Tennesse
»
terbio
»
titanio
»
torio
»
tulio
»
uranio
»
vanadio
»
xeno
»
zinco
»
zirconio
»
zolfo
mineralogia
elementi
C carbonio
C - carbonio - ALTRO NON METALLICO
Il carbonio è un elemento chimico essenziale per la vita e per la fabbricazione di prodotti di ogni tipo. È rappresentato dal simbolo C e si trova in abbondanza nell'ambiente come carbonio organico (come nel carbone, negli idrocarburi, ecc.) e in forma inorganica (come anidride carbonica [CO2], monossido di carbonio [CO], ecc.). È un elemento vitale della vita organizzata sulla Terra.
Il carbonio è incolore, inodore e si combina con altri elementi per formare composti organici e inorganici. È considerato uno dei tre elementi che svolgono un ruolo importante nella chimica organica (insieme all'idrogeno e all'ossigeno). Il carbonio si lega a se stesso e ad altri elementi per formare molecole le cui proprietà sono determinate dal tipo di legame tra gli atomi di carbonio.
Il carbonio è un elemento versatile e le molecole che forma possono avere proprietà diverse. Le proprietà più importanti del carbonio sono la conduttività elettrica, la resistenza termica e la capacità di assorbire l'umidità. I prodotti a base di carbonio sono ampiamente utilizzati nell'industria e nella vita di tutti i giorni. I principali prodotti a base di carbonio sono combustibili, plastica, coloranti, inchiostri, acciaio, tessuti e prodotti chimici per cosmetici e medicinali.
Il carbonio è anche un elemento importante per la produzione e lo stoccaggio di energia. Il carbonio viene utilizzato per generare energia nelle centrali elettriche e può essere immagazzinato sotto forma di carbone, gas naturale e petrolio. I combustibili fossili possono essere convertiti in energia dal carbonio che contengono. Il carbonio può anche essere immagazzinato sotto forma di biomassa (sostanza vegetale o animale organica), anidride carbonica o sostanze chimiche a base di carbonio.
Il carbonio è incolore, inodore e si combina con altri elementi per formare composti organici e inorganici. È considerato uno dei tre elementi che svolgono un ruolo importante nella chimica organica (insieme all'idrogeno e all'ossigeno). Il carbonio si lega a se stesso e ad altri elementi per formare molecole le cui proprietà sono determinate dal tipo di legame tra gli atomi di carbonio.
Il carbonio è un elemento versatile e le molecole che forma possono avere proprietà diverse. Le proprietà più importanti del carbonio sono la conduttività elettrica, la resistenza termica e la capacità di assorbire l'umidità. I prodotti a base di carbonio sono ampiamente utilizzati nell'industria e nella vita di tutti i giorni. I principali prodotti a base di carbonio sono combustibili, plastica, coloranti, inchiostri, acciaio, tessuti e prodotti chimici per cosmetici e medicinali.
Il carbonio è anche un elemento importante per la produzione e lo stoccaggio di energia. Il carbonio viene utilizzato per generare energia nelle centrali elettriche e può essere immagazzinato sotto forma di carbone, gas naturale e petrolio. I combustibili fossili possono essere convertiti in energia dal carbonio che contengono. Il carbonio può anche essere immagazzinato sotto forma di biomassa (sostanza vegetale o animale organica), anidride carbonica o sostanze chimiche a base di carbonio.
sintetico
Radioattivo
Liquido
Gassoso
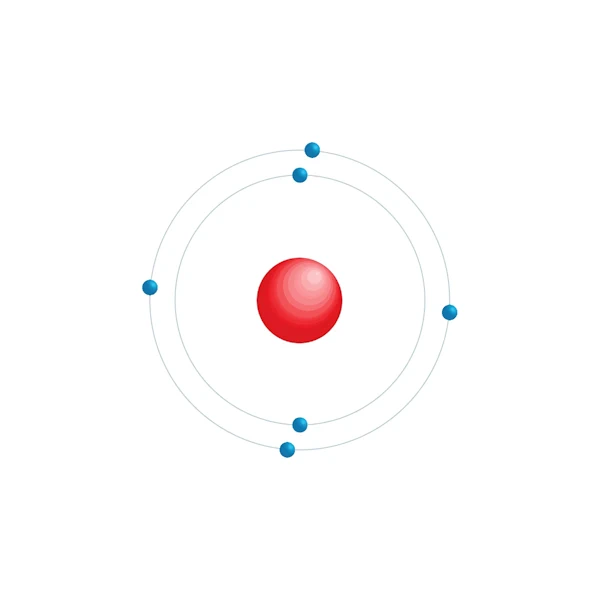
Schema di configurazione elettronico
| Nome | carbonio |
| Numero | 6 |
| Atomico | 12.0112 |
| Simbolo | C |
| Fusione | 3550 |
| Bollente | 4827 |
| Densità | 2.267 |
| Periodo | 2 |
| Gruppo | 14 |
| Scoperta | 0 Prehistoric |
| Abbondanza | 200 |
| Raggio | 0.91 |
| Elettronegatività | 2.55 |
| Ionizzazione | 11.2603 |
| Numero di isotopi | 7 |
| Configurazione elettronica | [He] 2s2 2p2 |
| Stati di ossidazione | -4,-3,-2,-1,1,2,3,4 |
| Elettrone per livello di energia | 2,4 |
| Minerale | Durezza | Densità |
| Abelsonite | 2.00 / 2.50 | 1.45 |
| Abenakiite-(Ce) | 4.00 / 4.00 | 3.21 |
| Acetamide | 1.00 / 1.50 | 1.17 |
| Adamsite-(Y) | 3.00 / 3.00 | |
| Aerinite | 3.00 / 3.00 | 2.48 |
| Afghanite | 5.50 / 6.00 | 2.55 |
| Agaite | 6.99 | |
| Agricolaite | 4.00 / 4.00 | 3.53 |
| Albrechtschraufite | 2.00 / 3.00 | 2.60 |
| Alexkhomyakovite | ||
| Alloriite | 5.00 / 5.00 | 2.35 |
| Alstonite | 4.00 / 4.50 | 3.69 |
| Alumohydrocalcite | 2.50 / 2.50 | 2.23 |
| Ambra | 2.00 / 2.50 | 1.10 |
| Ammonite | 6.00 / 7.00 | 3.20 |
| Ancylite-(Ce) | 4.50 / 4.50 | 3.90 |
| Ancylite-(La) | 4.00 / 4.50 | 3.88 |
| Andersonite | 2.50 / 2.50 | 2.79 |
| Ankerite | 3.50 / 4.00 | 3.00 |
| Antipinite | 2.00 / 2.00 | 2.55 |
| aragonite | 3.50 / 4.00 | 2.93 |
| Arisite-(Ce) | ||
| Arisite-(La) | 3.00 / 3.50 | 4.07 |
| Armangite | 4.00 / 4.00 | 4.43 |
| Artinite | 2.50 / 2.50 | 2.00 |
| Ashburtonite | 4.69 | |
| Ashcroftine-(Y) | 5.00 / 5.00 | 2.61 |
| Astrocyanite-(Ce) | 2.00 / 3.00 | 3.80 |
| Aurichalcite | 2.00 / 2.00 | 3.64 |
| azzurrite | 3.50 / 4.00 | 3.77 |
| Balliranoite | ||
| Barbertonite | 1.50 / 2.00 | 2.10 |
| Barentsite | 3.00 / 3.00 | 2.56 |
| Barringtonite | 2.83 | |
| Barstowite | 3.00 / 3.00 | 5.50 |
| Barytocalcite | 4.00 / 4.00 | 3.64 |
| Bastnäsite-(Ce) | 4.00 / 5.00 | 4.95 |
| Bastnäsite-(La) | 4.00 / 5.00 | 4.95 |
| Bastnäsite-(Nd) | 4.00 / 4.50 | 5.23 |
| Bastnäsite-(Y) | 4.00 / 4.50 | 4.90 |
| Bayleyite | 2.05 | |
| Baylissite | 2.00 | |
| Benstonite | 3.00 / 4.00 | 3.60 |
| Beyerite | 2.00 / 3.00 | 6.56 |
| Bijvoetite-(Y) | 2.00 / 2.00 | 3.90 |
| Biraite-(Ce) | 5.00 / 5.00 | 4.76 |
| Birunite | 2.00 / 2.00 | 2.36 |
| Bismutite | 4.00 / 4.00 | 7.00 |
| Blatonite | 2.00 / 3.00 | 3.99 |
| Bonshtedtite | 4.00 / 4.00 | 2.95 |
| Borcarite | 4.00 / 4.00 | 2.77 |
| Bosoite | ||
| Bradleyite | 3.00 / 4.00 | 2.73 |
| Braunerite | ||
| Brenkite | 3.10 | |
| Brianyoungite | 2.00 / 2.50 | 3.93 |
| Britvinite | 3.00 / 3.00 | 5.51 |
| Brugnatellite | 2.00 / 2.00 | 2.14 |
| Burbankite | 3.50 / 3.50 | 3.50 |
| Burkeite | 3.50 / 3.50 | 2.57 |
| Bussenite | 4.00 / 4.00 | 3.63 |
| Bütschliite | 2.00 | |
| Calcioancylite-(Ce) | 4.00 / 4.50 | |
| Calcioancylite-(Nd) | 4.00 / 4.50 | |
| Calcioburbankite | 3.00 / 4.00 | 3.45 |
| Calcite | 3.00 / 3.00 | 2.71 |
| Calclacite | 1.00 | |
| Caledonite | 2.50 / 3.00 | 5.70 |
| Calkinsite-(Ce) | 2.50 / 2.50 | 3.27 |
| Callaghanite | 3.00 / 3.50 | 2.71 |
| Camérolaite | 3.10 | |
| Canavesite | 1.80 | |
| Cancrinite | 6.00 / 6.00 | 2.40 |
| Cancrisilite | 5.00 / 5.00 | 2.40 |
| Caoxite | 2.00 / 2.50 | 1.85 |
| Carboborite | 2.00 / 2.00 | 2.12 |
| Carbobystrite | 6.00 / 6.00 | 2.37 |
| Carbocernaite | 3.00 / 3.00 | 3.53 |
| Carbokentbrooksite | 5.00 / 5.00 | 3.14 |
| Carbonate-fluorapatite | 5.00 / 5.00 | 3.12 |
| Carbonate-hydroxylapatite | 5.00 / 5.00 | 3.00 |
| Carbonatecyanotrichite | 2.00 / 2.00 | 2.65 |
| Carborandite | ||
| Caresite | 2.00 / 2.00 | 2.57 |
| Carletonite | 4.00 / 4.50 | 2.45 |
| Carpathite | 1.50 / 1.50 | 1.29 |
| Carraraite | ||
| Carrboydite | 2.50 | |
| Caysichite-(Y) | 4.50 / 4.50 | 3.03 |
| Cebaite-(Ce) | 4.50 / 5.00 | 4.81 |
| Cebaite-(Nd) | 4.50 / 5.00 | 4.80 |
| Cejkaite | 3.67 | |
| Cerussite | 3.00 / 3.50 | 6.50 |
| Chalconatronite | 1.00 / 2.00 | 2.27 |
| Chanabayaite | 2.00 / 2.00 | 1.46 |
| Chaoite | 1.00 / 2.00 | 3.33 |
| Charmarite | ||
| Chibaite | 6.50 / 7.00 | 1.93 |
| Chlorartinite | 1.87 |
 mineraly.fr
mineraly.fr
 mineraly.co.uk
mineraly.co.uk
 mineraly.com.de
mineraly.com.de
 mineraly.it
mineraly.it
 mineraly.es
mineraly.es
 mineraly.nl
mineraly.nl
 mineraly.pt
mineraly.pt
 mineraly.se
mineraly.se