Elenco di elementi
»
afnio
»
americio
»
Argento
»
argo
»
arsenico
»
astato
»
attinio
»
azoto
»
bario
»
berillio
»
bismuto
»
bohrium
»
Boro
»
bromo
»
cadmio
»
calcio
»
carbonio
»
cerio
»
cesio
»
cloro
»
cobalto
»
cromo
»
curio
»
dubnio
»
elio
»
erbio
»
europio
»
fermium
»
ferro
»
flerovio
»
fluoro
»
fosforo
»
francium
»
gallio
»
germanio
»
hassium
»
idrogeno
»
indio
»
iodio
»
iridio
»
itterbio
»
ittrio
»
krypton
»
lantanio
»
latta
»
litio
»
lutezio
»
magnesio
»
mercurio
»
neodimio
»
neon
»
nettunio
»
nichel
»
Nihonium
»
niobio
»
Nobelium
»
olmio
»
oro
»
osmio
»
ossigeno
»
palladio
»
platino
»
plutonio
»
polonio
»
portare
»
potassio
»
prometeo
»
radio
»
radon
»
rame
»
renio
»
rodio
»
rubidio
»
rutenio
»
samario
»
scandio
»
selenio
»
silicio
»
sodio
»
stronzio
»
tallio
»
tantalio
»
tecnezio
»
tellurio
»
Tennesse
»
terbio
»
titanio
»
torio
»
tulio
»
uranio
»
vanadio
»
xeno
»
zinco
»
zirconio
»
zolfo
Na - sodio - METALLO ALCALINO
Il sodio è un elemento chimico della famiglia dei metalli alcalini che porta il simbolo chimico Na. È l'elemento fondamentale più abbondante negli oceani ed è uno degli elementi più abbondanti sulla Terra.
Il sodio puro è un metallo morbido, bianco-argenteo. Fu scoperto da Sir Humphrey Davy nel 1807. È molto reattivo e reagisce molto facilmente con l'acqua per formare idrogeno e idrossido di sodio.
Il sodio è ampiamente utilizzato nell'industria alimentare, essendo utilizzato per salare il cibo. È anche ampiamente utilizzato nell'industria chimica e per realizzare prodotti a base di sale. Il sodio è utilizzato anche nell'industria dell'alluminio per produrre alluminio.
Le principali caratteristiche del sodio sono la sua bassa densità e la sua bassa conducibilità termica ed elettrica. Ciò significa che è un ottimo isolante termico ed elettrico. Ha anche una bassa tensione di vapore ed è molto solubile in acqua.
Le proprietà chimiche del sodio sono principalmente dovute alla sua elevata reattività. Il sodio è molto reattivo con acqua, ossigeno, acido solforico e altre sostanze. I prodotti di reazione con l'ossigeno sono ossidi, mentre quelli con acqua sono idrossidi e carbonati.
Il sodio è utilizzato in molte applicazioni industriali perché è molto reattivo e abbondante. Alcuni degli usi comuni includono la produzione di sali e l'utilizzo come catalizzatore in alcune reazioni chimiche. Viene utilizzato anche nell'industria alimentare per conservare gli alimenti e migliorarne il gusto. Viene utilizzato anche per la produzione di alluminio e per il trattamento delle acque reflue.
Il sodio puro è un metallo morbido, bianco-argenteo. Fu scoperto da Sir Humphrey Davy nel 1807. È molto reattivo e reagisce molto facilmente con l'acqua per formare idrogeno e idrossido di sodio.
Il sodio è ampiamente utilizzato nell'industria alimentare, essendo utilizzato per salare il cibo. È anche ampiamente utilizzato nell'industria chimica e per realizzare prodotti a base di sale. Il sodio è utilizzato anche nell'industria dell'alluminio per produrre alluminio.
Le principali caratteristiche del sodio sono la sua bassa densità e la sua bassa conducibilità termica ed elettrica. Ciò significa che è un ottimo isolante termico ed elettrico. Ha anche una bassa tensione di vapore ed è molto solubile in acqua.
Le proprietà chimiche del sodio sono principalmente dovute alla sua elevata reattività. Il sodio è molto reattivo con acqua, ossigeno, acido solforico e altre sostanze. I prodotti di reazione con l'ossigeno sono ossidi, mentre quelli con acqua sono idrossidi e carbonati.
Il sodio è utilizzato in molte applicazioni industriali perché è molto reattivo e abbondante. Alcuni degli usi comuni includono la produzione di sali e l'utilizzo come catalizzatore in alcune reazioni chimiche. Viene utilizzato anche nell'industria alimentare per conservare gli alimenti e migliorarne il gusto. Viene utilizzato anche per la produzione di alluminio e per il trattamento delle acque reflue.
sintetico
Radioattivo
Liquido
Gassoso
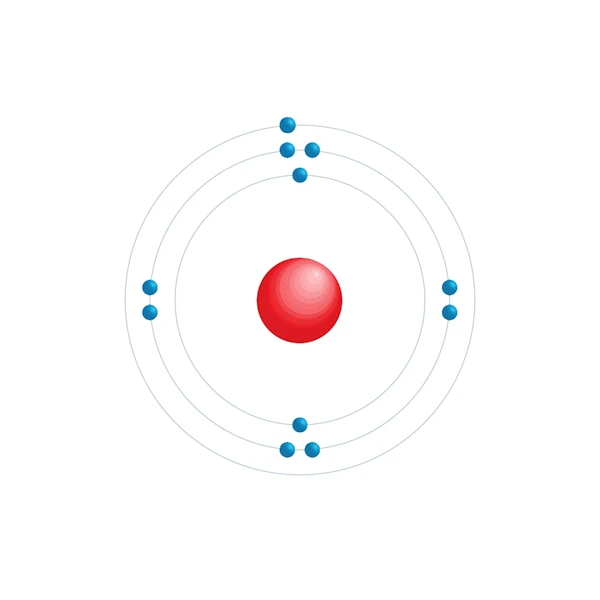
Schema di configurazione elettronico
| Nome | sodio |
| Numero | 11 |
| Atomico | 22.98976928 |
| Simbolo | Na |
| Fusione | 97.8 |
| Bollente | 892 |
| Densità | 0.971 |
| Periodo | 3 |
| Gruppo | 1 |
| Scoperta | 1807 Davy |
| Abbondanza | 23600 |
| Raggio | 2.2 |
| Elettronegatività | 0.93 |
| Ionizzazione | 5.1391 |
| Numero di isotopi | 7 |
| Configurazione elettronica | [Ne] 3s1 |
| Stati di ossidazione | -1,1 |
| Elettrone per livello di energia | 2,8,1 |
| Minerale | Durezza | Densità |
| Abenakiite-(Ce) | 4.00 / 4.00 | 3.21 |
| Acmonidesite | ||
| Actinolite | 5.50 / 5.50 | 2.98 |
| Adamsite-(Y) | 3.00 / 3.00 | |
| Adranosite | ||
| Adranosite-(Fe) | 2.20 | |
| Aegirine | 6.00 / 6.50 | 3.50 |
| Aegirine-augite | 6.00 / 6.00 | 3.40 |
| Aenigmatite | 5.00 / 6.00 | 3.74 |
| Aerinite | 3.00 / 3.00 | 2.48 |
| Afghanite | 5.50 / 6.00 | 2.55 |
| Agrellite | 5.50 / 5.50 | 2.88 |
| Aiolosite | 3.59 | |
| Ajoite | 2.96 | |
| Albite | 7.00 / 7.00 | 2.61 |
| Alexkhomyakovite | ||
| Alflarsenite | 4.00 / 4.00 | 2.61 |
| Aliettite | 1.00 / 2.00 | |
| Alloriite | 5.00 / 5.00 | 2.35 |
| Alluaivite | 5.00 / 6.00 | 2.76 |
| Alluaudite | 5.00 / 5.50 | 3.45 |
| Almarudite | 6.00 / 6.00 | 2.71 |
| Alnaperbøeite-(Ce) | ||
| Alsakharovite-Zn | 5.00 / 5.00 | 2.90 |
| Altisite | 6.00 / 6.00 | 2.64 |
| Alum-(Na) | 3.00 / 3.00 | 1.67 |
| Alumino-ferrobarroisite | ||
| Alumino-ferrowinchite | ||
| Alumino-magnesiotaramite | ||
| Alumino-ottoliniite | ||
| Aluminobarroisite | 5.00 / 6.00 | 2.94 |
| Aluminokatophorite | 5.00 / 6.00 | |
| Aluminowinchite | ||
| Alumoåkermanite | 4.00 / 5.00 | 3.00 |
| Amarillite | 2.50 / 3.00 | 2.19 |
| Amblygonite | 5.50 / 6.00 | 2.98 |
| Ameghinite | 2.00 / 3.00 | 2.02 |
| Amicite | 5.00 / 5.50 | 2.06 |
| Analcime | 5.00 / 5.00 | 2.30 |
| Andersonite | 2.50 / 2.50 | 2.79 |
| Andesine | 7.00 / 7.00 | 2.66 |
| Andrianovite | 5.00 / 5.00 | 3.02 |
| Angarfite | 2.50 / 2.50 | 2.77 |
| Anorthite | 6.00 / 6.00 | 2.72 |
| Anorthoclase | 6.00 / 6.00 | 2.57 |
| Antipinite | 2.00 / 2.00 | 2.55 |
| Apexite | 2.00 / 2.00 | 1.74 |
| Aphthitalite | 3.00 / 3.00 | 2.70 |
| Aqualite | 4.00 / 5.00 | 2.66 |
| Arapovite | 5.50 / 6.00 | 3.43 |
| Arctite | 5.00 / 5.00 | 3.11 |
| Ardennite-(V) | 6.00 / 7.00 | 3.55 |
| Arfvedsonite | 5.50 / 6.00 | 3.44 |
| Arisite-(Ce) | ||
| Arisite-(La) | 3.00 / 3.50 | 4.07 |
| Aristarainite | 3.50 / 3.50 | 2.03 |
| Armbrusterite | 3.50 / 3.50 | 2.78 |
| Arnhemite | 2.33 | |
| Arrojadite-(BaFe) | 3.54 | |
| Arrojadite-(BaNa) | ||
| Arrojadite-(KFe) | 5.00 / 5.00 | 3.50 |
| Arrojadite-(KNa) | ||
| Arrojadite-(NaFe) | ||
| Arrojadite-(PbFe) | 4.00 / 5.00 | |
| Arrojadite-(SrFe) | ||
| Arseniopleite | 3.50 / 3.50 | 4.22 |
| Arsmirandite | ||
| Ashcroftine-(Y) | 5.00 / 5.00 | 2.61 |
| Aspidolite | 2.00 / 3.00 | 2.89 |
| Astrophyllite | 3.00 / 3.50 | 3.30 |
| Augite | 5.00 / 6.50 | 3.20 |
| Bakhchisaraitsevite | 2.00 / 2.50 | 2.50 |
| Balliranoite | ||
| Banalsite | 6.00 / 6.00 | 3.07 |
| Bannermanite | 3.50 | |
| Bannisterite | 4.00 / 4.00 | 2.83 |
| Barahonaite-(Al) | ||
| Barahonaite-(Fe) | 3.03 | |
| Barentsite | 3.00 / 3.00 | 2.56 |
| Bario-olgite | 4.00 / 4.50 | 4.00 |
| Barnesite | 3.00 / 3.00 | 3.15 |
| Barrerite | 3.00 / 4.00 | 2.13 |
| Barroisite | 5.00 / 6.00 | 3.00 |
| Barrydawsonite-(Y) | ||
| Barytolamprophyllite | 2.00 / 3.00 | 3.62 |
| Batiferrite | 6.00 / 6.00 | |
| Batisite | 5.90 / 5.90 | 3.43 |
| Bazzite | 6.50 / 6.50 | 2.80 |
| Bederite | 5.00 / 5.00 | 3.48 |
| Beidellite | 1.00 / 2.00 | 2.00 |
| Belakovskiite | ||
| Bellbergite | 5.00 / 5.00 | 2.20 |
| Belovite-(Ce) | 5.00 / 5.00 | 4.19 |
| Belovite-(La) | 5.00 / 5.00 | 4.19 |
| Benyacarite | 2.50 / 3.00 | 2.40 |
| Beryllonite | 5.50 / 6.00 | 2.80 |
| Berzeliite | 4.50 / 5.00 | 4.08 |
| Betalomonosovite | ||
| Betpakdalite-NaCa | 2.89 |
 mineraly.fr
mineraly.fr
 mineraly.co.uk
mineraly.co.uk
 mineraly.com.de
mineraly.com.de
 mineraly.it
mineraly.it
 mineraly.es
mineraly.es
 mineraly.nl
mineraly.nl
 mineraly.pt
mineraly.pt
 mineraly.se
mineraly.se